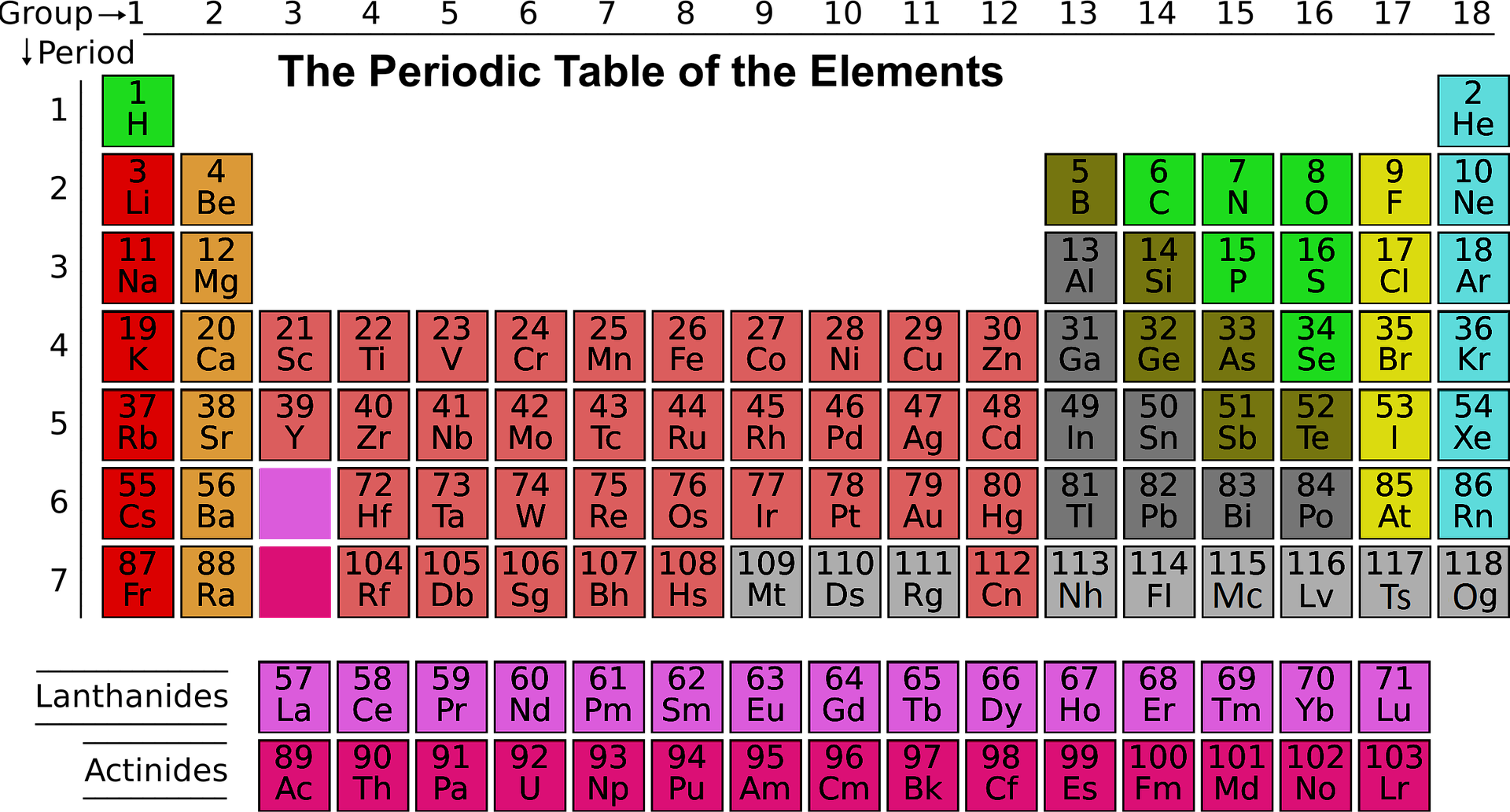
Historia Tablicy Mendelejewa

Dmitrij Mendelejew, Rosjanin pracując nad układem okresowym, musiał poprawiać błędy innych naukowców, a puste miejsca w układzie tłumaczył istnieniem nieznanych, tajemniczych pierwiastków. Stworzenie teorii na takich założeniach było bardzo ryzykownym krokiem dla naukowca.
Co jest wyznacznikiem wielkiego naukowca? Odkrycie nowych informacji, połączenie ich ze znanymi, a idąc dalej, przewidzenie konsekwencji swojego odkrycia. Jednak wybijające się umysły będą również w stanie opracować metody pomiaru i weryfikacji swoich założeń. Prawdziwie wielcy naukowcy to ci, których koncepcje zostaną finalnie uznane za słuszne. Z drugiej strony, teoria jeśli nie zostanie potwierdzona, może zdyskredytować cały dotychczasowy dorobek naukowy.
Mendelejew nie był jedynym naukowcem, który próbował rozszyfrować zagadkę okresowości pierwiastków, John Newlands, Frenchman Alexandre Béguyer de Chancourtois oraz German Julius Lothar Meyer również mieli znaczący wkład w rozwój tego pomysłu. Dlaczego jednak to Rosjanin stał się ojcem słynnej tablicy?
W owym czasie próbując ustalić zależności między poszczególnymi elementami chemicznymi, naukowcy bazowali na wydanej w 1860 roku publikacji, określającej dokładnie wagę atomową pierwiastków, jak nazywano wtedy względną masę atomową. Naukowcy napotykali na dwa podstawowe problemy w określeniu wzorca zależności między elementami. Pierwszym z nich było to, że w owym czasie znanych było zaledwie 60 pierwiastków (dzisiaj mamy ich ponad 100), po drugie część informacji, na temat tych znanych, jak się później okazało, była błędna. Mendelejew próbował więc stworzyć system, nie znając jednej trzeciej elementów układanki i bazując na błędnych danych!
Mendelejew wypisał właściwości wszystkich znanych elementów na osobnych kartach. Jak głosi historia po cierpliwych przetasowaniach i próbach ułożenia ich w logiczny system, okrył, że układając pierwiastki w porządku rosnącej liczby atomowej, zaczął ujawniać się wzór. Zauważył, że po niereaktywnych niemetalach następowały bezpośrednio bardzo reaktywne metale lekkie, a po nich z kolei mniej reaktywne metale lekkie.
Wkrótce jego pomysł został przedstawiony przed Rosyjskim Towarzystwem Chemicznym. Tezy Mendelejewa zostały odczytane przed zgromadzeniem przez prof. Mienszutkina, ponieważ odkrywca był w tym czasie chory. Jego idee zostały następnie opublikowane w głównym niemieckim periodyku chemicznym tamtych czasów „Zeitschrift fϋr Chemie”.

Pamiątkowy znaczek kolekcjonerski wydany na pamiątkę setnej rocznicy sformułowania układu okresowego, na tle oryginalnych zapisków naukowca.
To, co stanowiło genialne odkrycie, było zarazem tym, co mogło zdyskredytować naukowca w przypadku obalenia jego założeń. Dlaczego to Mendelejew, a nie inni chemicy stał się ojcem układu okresowego?
Po pierwsze dlatego, że umieścił pierwiastki w odpowiednich miejscach w tabeli. W niektórych przypadkach względna masa atomowa pierwiastków była źle obliczona przez wcześniejszych chemików. Poprzez skorygowanie ich obliczeń, udało mu się prawidłowo określić ich właściwości oraz położenie w układzie.
W tamtych czasach względną masę atomową wyliczano za pomocą następującego równania:
masa atomowa = masa równoważna x wartościowość
Masa równoważna była określana prawidłowo, czasem błąd pojawiał się przy wartościowości. Przykładowo beryl miał masę równoważną określoną jako 4.6, a wartościowość jako 3, ponieważ chemicznie był podobny do aluminium. To dało masę atomową 13.8, umieszczając tym samym beryl pomiędzy węglem a azotem, gdzie faktycznie nie powinien się znajdować. Mendelejew stwierdził natomiast, że wartościowość pierwiastka powinna wynosić 2 – to rozwiązywało problem – beryl jak najbardziej pasował między litem a borem.
Po drugie Mendelejew doszedł do wniosku, że waga atomów musi być źle obliczona, ponieważ pierwiastki pojawiały się w nieadekwatnych miejscach na tablicy. Przykładowo zdecydował się umieścić tellur przed jodem, mimo iż jego masa atomowa była większa niż jodu, stwierdzając, że właściwości jodu są bardziej podobne do fluoru, chloru i bromu, a telluru do tlenu, siarki i selenu. Teraz już wiemy, że to liczba atomowa, a nie względna masa atomowa reguluje pozycję danego elementu w układzie okresowym, mimo iż w większości przypadków wynik ułożyłby pierwiastki w tej samej kolejności.
Rozwiązanie Rosjanina pozwoliło mu na pozostawienie w układzie pustych miejsc dla pierwiastków, które mały dopiero zostać odkryte. Układ pozwalał więc wstępnie przewidzieć już pewne właściwości tych nieznanych jeszcze elementów. Proponując takie rozwiązanie, ryzykował, jednak 15 lat później, jeszcze za życia Mendelejewa, udało się odkryć 3 nowe pierwiastki.

Pierwszy z nich, określony przez Rosjanina w niepełnej tabeli jako eka-aluminium, czyli „pierwszy po aluminium” (eka w sanskrycie oznacza „jeden”), został odkryty w Paryżu przez Paul Emile Lecoq de Boisbaudrana (1875), który nazwał pierwiastek galem, od łacińskiej nazwy Francji. Jednak określona przez francuza gęstość galu różniła się o od tej, przewidzianej przez Mendelejewa, rzucając cień na prawdziwość jego założeń. Mendelejew poprosił odkrywcę o dokonanie ponownego pomiaru. Jak się okazało, pierwsze obliczenie gęstości było nieprawidłowe, kolejne poprawne wyliczenie zgadzało się z założeniami Mendelejewa i tym samym potwierdziło jego teorię na temat konstrukcji tablicy.
W ciągu kolejnej dekady Szwed Lars Nilson zidentyfikował skand (1879), przewidziany przez Mendelejewa jako „eka-bor”, a Niemiec Clemens Winkler potwierdził istnienie germanu (1886), który w tablicy miał być eka-krzemem. Te odkrycia ostatecznie potwierdziły słuszność tablicy Mendelejewa, mimo iż kolejne dwa pierwiastki, którym pozostawiono miejsce na tablicy, były nieznane jeszcze przez kolejnych 50 lat.
To, czego Mendelejew natomiast nie przewidział, to cała nowa grupa elementów – gazów szlachetnych, które zostały odkryte dopiero w ostatniej dekadzie XIX wieku przez Szkota Williama Ramsaya. Początkowo Mendelejew był przerażony odkryciem, obawiając się obalenia swojego założenia. Finalnie przed śmiercią w 1907 roku doszedł jednak do wniosku, że nowa grupa nie była zaprzeczeniem, lecz uzupełnieniem jego teorii. Ramsay za odkrycie pięciu nowych pierwiastków otrzymał nagrodę Nobla. Mendelejew nigdy nie dostał tego wyróżnienia, na jego cześć nazwano za to pierwiastek o liczbie atomowej 101 – mendelew, co w świecie nauki jest jeszcze rzadszym wyróżnieniem.
Ostatnio naukowcom udało się uzupełnić tablicę o cztery kolejne pierwiastki. Artykuł możecie przeczytać tutaj.